
Tratamento da Trombocitose Essencial (TE)
Considerações iniciais
As plaquetas são partículas sanguíneas semelhantes a células que ajudam o organismo na formação de coágulos de sangue. As plaquetas são normalmente produzidas na medula óssea por células denominadas megacariócitos. Na trombocitemia, os megacariócitos aumentam em número e produzem plaquetas demais. A trombocitemia pode ser
Primária (essencial): causada por um distúrbio de células formadoras de plaquetas
Secundária: causada por um distúrbio que desencadeia o aumento de produção por células formadoras de plaquetas normais.
A trombocitemia essencial geralmente ocorre em pessoas com mais de 50 anos de idade. Às vezes, pacientes mais jovens, sobretudo mulheres jovens, são afetados.
A trombocitemia essencial é considerada uma neoplasia mieloproliferativa, na qual algumas células produtoras de sangue na medula óssea se reproduzem de maneira excessiva. A causa é uma mutação genética que geralmente ocorre nos genes da Janus quinase 2 (JAK2), da calreticulina (CALR) ou do receptor da trombopoietina (MPL). A mutação mais comum é a do gene JAK2 que causa aumento da atividade da enzima JAK2, uma proteína que causa produção de células em excesso.
1. Objetivos do tratamento
- Reduzir risco de trombose (principal causa de morbidade/mortalidade)
- Controlar sintomas (cefaleia, eritromelalgia, distúrbios visuais)
- Evitar evolução para mielofibrose / LMA (não é o foco principal)
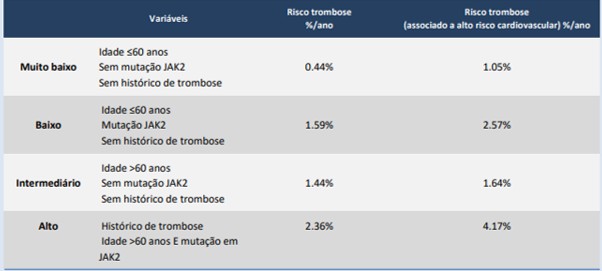
2. Classificação de risco
A conduta depende do risco trombótico:
Baixo risco
- Idade < 60 anos
- Sem história de trombose
- Sem fator JAK2 positivo OU com JAK2, mas plaquetas <1.000.000/mm³ e sem sintomas.
Alto risco
- ≥ 60 anos
- Ou trombose prévia
- Ou presença de JAK2 V617F (risco aumentado)
- Ou plaquetas muito elevadas (> 1.500.000/mm³) → risco de vWF adquirido e sangramento
3. Tratamento conforme risco
🟢 BAIXO RISCO
a) AAS
AAS 75–100 mg/dia
Indicado se o paciente tem mutação JAK2 ou sintomas microvasculares.
Não usar AAS se: plaquetas >1.000.000–1.500.000/mm³, pelo risco de Doença de von Willebrand adquirida.
b) Sem citorredução rotineira
Exceções onde pode-se considerar citorredução mesmo em baixo risco:
- Eritromelalgia severa
- Plaquetas muito altas (risco de vWF adquirido)
- Sangramento
- Paciente que recusa risco pleno trombótico
🔴 ALTO RISCO
a) Citorredução obrigatória
Opções:
a.1) Hidroxiureia (primeira linha)
Droga padrão (maior evidência, segura e barata)
Meta: normalizar plaquetas < 450–600k
a.2) Interferon alfa peguilado (PEG-IFN)
Indicações:
- Jovens <40 anos
- Gestantes (única droga segura)
- Intolerância/contraindicação à hidroxiureia
- Desejo de fertilidade
Indicado para pacientes intolerantes, resistentes ou com contra-indicação (ex gestantes) a HU. A posologia varia de acordo com o tipo de IFN utilizado. Dose inicial peg IFN alfa: 45mcg semanal, com incrementos de 45 mcg mensais até a dose máxima de 180 mcg/semana.
Os principais eventos adversos do peg IFN alfa são: reações alérgicas no sítio de infusão, sintomas “flu-like”, neuropatia sensorial, leucopenia, depressão e elevação de aminotransferases.
a.3) Anagrelida
É um agente antitrombocítico ou inibidor da maturação plaquetária, inibidor de fosfodiesterase que interfere diretamente na maturação megacariocítica. Indicado para reduzir a contagem de plaquetas e diminuir o risco de eventos trombo-hemorrágicos em pacientes com trombocitemia essencial decorrente de neoplasias mieloproliferativas, especialmente como terapia de segunda linha, quando hidroxiureia e IFN não podem ser usados. A anagrelida inibe a maturação das plaquetas a partir dos megacariócitos na medula óssea. Maior risco de fibrose e eventos cardíacos → NÃO é primeira linha
b) AAS
AAS 75–100 mg/dia para todos, exceto se houver disfunção do vWF.
4. Trombocitose extrema (plaquetas > 1.500.000/mm³)
- Risco de Síndrome de von Willebrand adquirida → pode sangrar.
Conduta:
Testar atividade do vWF (RCo)
- Se ↓ vWF → NÃO usar AAS
- Iniciar citorredução imediata (geralmente hidroxiureia)
5. Gestação
Interferon-alfa (único seguro)
AAS em dose baixa se vWF normal
Heparina profilática no pós-parto, dependendo do risco
6. Situações especiais
Trombose arterial/venosa aguda → tratar trombose + controlar plaquetas com hidroxiureia urgente
Eritromelalgia → responde muito bem a AAS
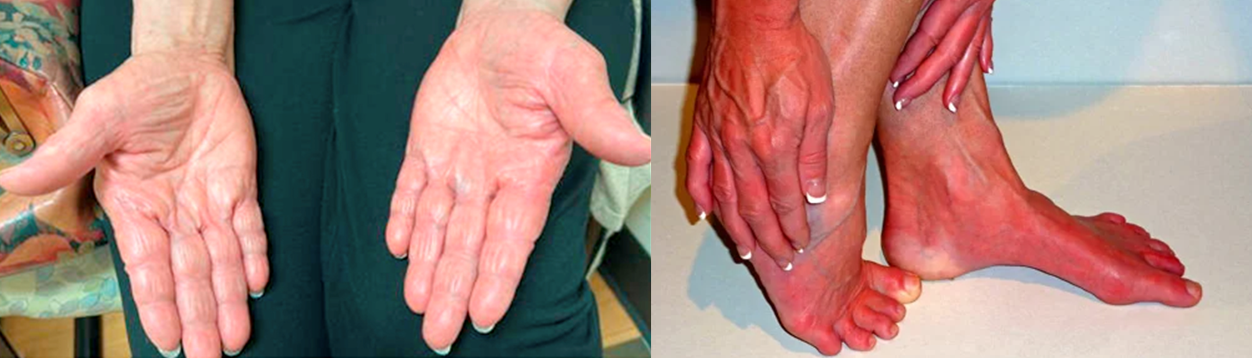
Figura ilustrativa de casos de Eritromelagia
Doses de HIDROXIUREIA (HU) para tratamento da Trombocitose Essencial (TE)
✅ 1. Dose inicial
Para adultos:
Hidroxiureia: 15–20 mg/kg/dia
Tomada VO, 1 vez ao dia.
Regra prática (baseada no peso):
Peso Dose inicial usual
50–60 kg 500 mg/dia
60–75 kg 1.000 mg/dia
75–90 kg 1.000–1.500 mg/dia
>90 kg 1.500 mg/dia
✅ 2. Ajuste da dose
Ajustar a cada 2–4 semanas de acordo com:
- Contagem de plaquetas
- Leucócitos
- Hemoglobina
Meta terapêutica
Plaquetas entre 400.000–600.000/mm³
(Alguns centros usam <450.000)
Ajuste típico
Aumentar 500 mg/dia se plaquetas continuam muito elevadas
Reduzir 500 mg/dia se neutrófilos < 2.000/mm³ ou anemia importante
✅ 3. Dose máxima
HU até 2.000–2.500 mg/dia
(Alguns pacientes toleram até 3.000 mg/dia, mas isso é exceção)
✅ 4. Quando reduzir ou suspender
Suspender temporariamente se:
- Neutrófilos < 1.500/mm³
- Plaquetas < 150.000/mm³
- Hemoglobina cai significativamente
Cuidado: Toxicidade cutânea ou úlceras
Após recuperação hematológica, reiniciar com dose 25–50% menor.
✅ 5. Tempo para resposta
Normalização das plaquetas: 4–12 semanas
Se após 3 meses na dose máxima não houver resposta → considerar:
- Interferon alfa peguilado
- Anagrelida (2ª linha)
Doses da ANAGRELIDA para tratamento da Trombocitose Essencial (TE).
✅ 1. Dose inicial
Anagrelida: 0,5 mg VO 2x/dia. Nome comercial Agrylin®
(ou 1 mg/dia total, divididos)
Alguns serviços iniciam 0,5 mg 1x/dia em pacientes idosos, cardiopatas ou com baixo peso.
✅ 2. Ajuste da dose
Ajustar a dose a cada 7 dias, no máximo:
Aumentar 0,5 mg por dia por semana, conforme resposta.
Exemplo:
Semana 1: 0,5 mg 2x/dia
Semana 2: 1 mg manhã + 0,5 mg noite (1,5 mg/dia)
Semana 3: 1 mg 2x/dia (2 mg/dia)
E assim por diante
✅ 3. Dose terapêutica usual
A maioria dos pacientes responde com:
1,5–2,5 mg/dia (divididos em 2–3 tomadas)
✅ 4. Dose máxima
Máximo permitido: 10 mg/dia
Máximo por tomada: 2,5 mg
Valores acima disto aumentam muito risco cardiovascular.
⚠️ 5. Cuidados importantes
Anagrelida tem efeitos cardiotóxicos potenciais:
- Taquicardia
- Arritmia
- Palpitações
- Retenção hídrica
- Insuficiência cardíaca (raro, mas descrito)
Por isso:
ECG antes de iniciar + cuidado em:
- Idosos
- Insuficiência cardíaca
- Doença coronariana
- Hipertensão não controlada
6. Metas terapêuticas
Mesmas da Hidroxiureia:
- Plaquetas entre 400.000–600.000/mm³
- Evitar plaquetas <150.000
7. Tempo para resposta
- Redução significativa de plaquetas: 7–14 dias
- Resposta plena: 4–6 semanas
CUIDADOS: Síndrome de von Willebrand
A síndrome de von Willebrand adquirida (SvW adquirida) é uma coagulopatia rara, não hereditária, causada por doenças que consumem, destroem ou inibem o fator von Willebrand (vWF). É importante porque aparece em pacientes adultos sem história familiar de sangramento, sendo um distúrbio hemorrágico em que ocorre redução funcional ou quantitativa do vWF, porém causada por outra doença subjacente. Não é genética e não existe história familiar.
🩸 DOENÇAS ASSOCIADAS
As mais comuns:
✔️ Doenças mieloproliferativas
Trombocitose essencial (principal causa)
Policitemia vera
Macroglobulinemia de Waldenström
Mieloma múltiplo
✔️ Doenças cardíacas
Estenose aórtica grave
Dispositivos mecânicos (bomba ventricular, ECMO)
✔️ Doenças autoimunes
Hipotireoidismo
Lupus
Síndrome antifosfolípide
✔️ Neoplasias
Linfomas
Leucemias
✔️ Medicamentos (raro)
Hidroxiureia
Ciprofloxacino
Valproato
🔎 QUADRO CLÍNICO
Semelhante à doença de von Willebrand hereditária:
- Equimoses fáceis
- Epistaxe
- Sangramento gengival
- Menorragia
- Sangramento pós-cirúrgico
- Hematomas
- Diferencial importante: Surge na vida adulta e não tem história familiar.
⭐ DIAGNÓSTICO — PASSO A PASSO
O diagnóstico é bioquímico e confirmatório. Envolve 4 pilares:
1) Exames básicos de rastreio
✔️ TAP (INR) → normal
✔️ TTPA → pode estar prolongado
✔️ Plaquetas → No caso da trombocitose essencial - muito altas. Plaquetas >1.000.000 podem sugerir TE com SvW adquirida
2) Dosagem quantitativa do vWF
vWF:Ag (antígeno von Willebrand) → reduzido (geralmente 10–50%)
3) Dosagem funcional do vWF
Este é essencial: → vWF:RCo (atividade cofator ristocetina)
Baixo, geralmente desproporcional ao antígeno.→ Relação vWF:RCo / vWF:Ag < 0,7
Altamente sugestivo de SvW ou déficit funcional
4) Multímeros de vWF
Confirmatório: ✔️ Perda dos multímeros de alto peso molecular
→ Achado típico da SvW adquirida
→ É o mesmo padrão da SvW tipo 2A
Outros exames úteis
Fator VIII: reduzido
Pesquisa de autoanticorpos anti-vWF
Ensaios de ligação plaquetária
Eletroforese para paraproteínas (caso suspeita de gamopatia monoclonal)
🔎 CRITÉRIOS DIAGNÓSTICOS
A SvW adquirida é diagnosticada quando há:
✔️Distúrbio hemorrágico recente em adulto, sem história familiar
✔️Doença sistêmica potencialmente causadora
✔️Exames compatíveis
- vWF:Ag baixo
- vWF:RCo baixo
- Relação RCo/Ag <0,7
- Multímeros ausentes ou reduzidos
- Resposta ao tratamento da doença de base.
✅ MODELO DE SOLICITAÇÃO DE EXAMES – INVESTIGAÇÃO DE SÍNDROME DE VON WILLEBRAND ADQUIRIDA
Hemograma completo
Coagulograma básico: TP com INR
TTPa
Fibrinogênio
Dosagem de Fator de von Willebrand:
vWF:Ag (antígeno do fator de von Willebrand)
vWF:RCo ou vWF:GPIbM (atividade do vWF)
Índice RCo/Ag ou GPIbM/Ag
Fator VIII: Atividade FVIII:C
Multímeros do vWF (análise qualitativa)
RIPA – Ristocetin-Induced Platelet Aggregation (Agregação plaquetária induzida por ristocetina)
Inibidores / anticorpos anti-vWF (quando disponível)
Eletroforese ou imunoblot de multímeros do vWF (se disponível)
Pesquisa de paraproteína caso haja suspeita de doença linfoproliferativa:
Eletroforese de proteínas séricas (EPS)
Imunofixação sérica e urinária
RESUMO DO QUE É ESSENCIAL
Se tiver que focar nos principais, peça:
vWF:Ag
vWF:RCo ou vWF:GPIbM
Fator VIII (FVIII:C)
Multímeros do vWF
RIPA
Anticorpos anti-vWF
✔️ Se quiser, posso montar:
☑️ Checklist completo de interpretação dos resultados,
☑️ Fluxograma diagnóstico,
☑️ Exemplos reais de casos clínicos,
☑️ Como diferenciar SvW adquirido do hereditário.
Plasmaférese
NÃO é tratamento de rotina para Trombocitose Essencial (TE) — mesmo quando as plaquetas estão muito altas.
Ela só é indicada em situações extremamente específicas.
✅ QUANDO a plasmaférese é indicada na TE
Apenas em casos raríssimos, quando há:
🔥 Trombocitose extrema (> 1,5 a 2 milhões/mm³) + eventos trombóticos ou hemorrágicos graves
Exemplos:
- AIT ou AVC em curso com plaquetas muito altas
- Trombose arterial grave com risco iminente
- Hemorragia grave por síndrome de von Willebrand adquirida (quando plaquetas estão >1.5–2 milhões)
- Emergências pré-cirúrgicas em que é necessário queda rápida de plaquetas
Nessas situações, a plasmaférese serve apenas como ponte até a ação da hidroxiureia ou anagrelida.
❌ QUANDO NÃO fazer plasmaférese
Não se recomenda plasmaférese quando:
- Paciente está estável
- Plaquetas abaixo de 1.500.000
- Não há hemorragia grave
- Não há evento trombótico maior em evolução
- Não há síndrome de von Willebrand adquirida grave
🎯 Por quê?
Porque a plasmaférese reduz as plaquetas apenas temporariamente (24–48h). A hidroxiureia e a anagrelida são os tratamentos definitivos.
Fontes
BARBUI, T. et al. Philadelphia‐negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. Journal of Clinical Oncology, v. 29, n. 6, p. 761–770, 2011.
MCMAULLIN, M. F. et al. A guideline for the diagnosis and management of essential thrombocythaemia. British Journal of Haematology, v. 189, n. 2, p. 319–338, 2020.
HARRISON, C. N. et al. Guideline for investigation and management of adults and children presenting with a thrombocytosis. British Journal of Haematology, v. 149, n. 3, p. 352–375, 2010.
NATIONAL COMPREHENSIVE CANCER NETWORK (NCCN). NCCN Clinical Practice Guidelines in Oncology: Myeloproliferative Neoplasms. Version 3.2024. Disponível em: https://www.nccn.org/guidelines. Acesso em: 27 nov. 2025.
TEFFERI, A.; BARBUI, T. Essential thrombocythemia and polycythemia vera: recent clinical progress and tomorrow’s challenges. American Journal of Hematology, v. 94, n. 6, p. 713–725, 2019.
CERVANTES, F. How I treat essential thrombocythemia. Blood, v. 128, n. 20, p. 2403–2414, 2016.
TEFFERI, A.; VARDIMAN, J. Essential thrombocythemia. New England Journal of Medicine, v. 355, n. 6, p. 558–568, 2006.
BARBUI, T.; FINAZZI, G.; FALANGA, A. Myeloproliferative neoplasms and thrombosis. Blood, v. 122, n. 13, p. 2176–2184, 2013.
FRUCHTMAN, S. M. et al. Long-term safety and efficacy of hydroxyurea in young patients with essential thrombocythemia. Cancer, v. 95, n. 8, p. 1766–1772, 2002.
FINAZZI, G. et al. Hydroxyurea in essential thrombocythemia: a 10-year study. Cancer, v. 95, n. 9, p. 1981–1985, 2002.
PETITTI, N. et al. Anagrelide in essential thrombocythemia: efficacy, toxicity and practical management. Leukemia Research, v. 82, p. 76–82, 2019.
GOMES, M. S. et al. Management of essential thrombocythemia with anagrelide: clinical evidence and practical considerations. Hematology Reports, v. 10, n. 1, p. 7283, 2018.
ARBER, D. A. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood, v. 127, n. 20, p. 2391–2405, 2016.
BARBUI, T. et al. The 2016 WHO classification and diagnostic criteria for myeloproliferative neoplasms. Blood Cancer Journal, v. 8, n. 2, p. 1–11, 2018.
https://medicalsuite.einstein.br/pratica-medica/Pathways/Trombocitemia-Essencial.pdf